

电话:010-88864112/ 010-88864113 / 010-88864114/13911567422
座机:
邮箱:kzkj@kestrelbj.cn
地址:北京市房山区沙岗街6号院二区3号楼1至3层101
 时间:2018-07-18
时间:2018-07-18
 阅读次数:次
阅读次数:次
凯卓科技2月28日讯 植介入医疗器械包括了心血管支架、药物洗脱球囊、骨科植入物、生物瓣膜等医用高值耗材,是目前医疗器械领域内发展迅速,也是市场空间巨大的类别。
根据CFDA发布的《2016年度医疗器械注册工作报告》,在境内第三类医疗器械和进口医疗器械的注册产品中,植入材料和人工器官这一类别的获批数量已经从2015年的第二位上升到了第一位。
2017年,CFDA加强医疗器械注册的监督管理,持续深入医疗器械审评审批制度。本文将根据CFDA披露的医疗器械注册信息,对《医疗器械分类目录》中介入器材(6877)与植入材料和人工器官(6846)这两个子目录在2017年批准的产品进行简单的统计。
由于介入器械尤其是心血管介入器械的技术壁垒较高,国内从事研发和生产支架、球囊等产品,尤其是药物支架、可降解支架以及药物球囊等高端器械的企业数量非常有限,而骨科植入物等器械的发展相对成熟,技术壁垒也相对较低,因此从整体获批的数量上来看,植入器械的获批数量远远高于介入器械。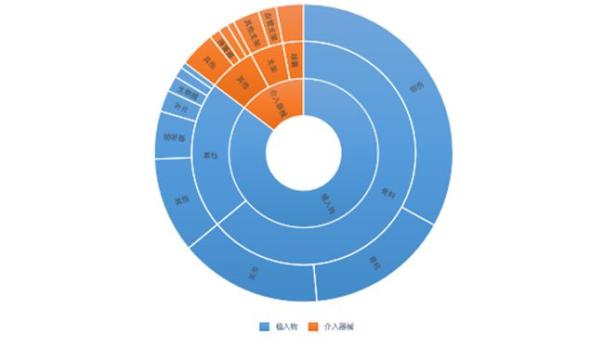
植介入器械批准数量对比
《中国制造2025》实施的两年以来,医疗器械的国产化明显加快,国产医疗器械正在快速崛起。2017年5月国务院召开了部署推进《中国制造2025》深入实施的常务会议,更加明确了重点发展影像设备、医用高值耗材等六大医疗器械国产化的路线。
2016年,境内三类和进口植入材料和人工器官的注册数量比为360:509,而2017年这一比例升高到了355:257,进口器械的获批明显减少,从一个侧面也反映出国家从医疗器械审评审批的层面基于医疗器械国产化的支撑。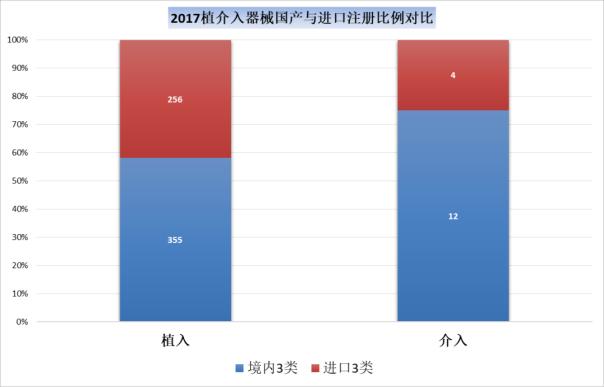
在骨科植入物中,接骨板、髓内钉等创伤类产品中,人工髋关节、膝关节等关节类产品和椎间融合器等脊柱类产品是最主要的三大类,除此之外还有骨水泥、生物陶瓷等其他的材料。
在2017年新获批的骨科植入物中,创伤类占到近半成,脊柱类和关节类平分秋色。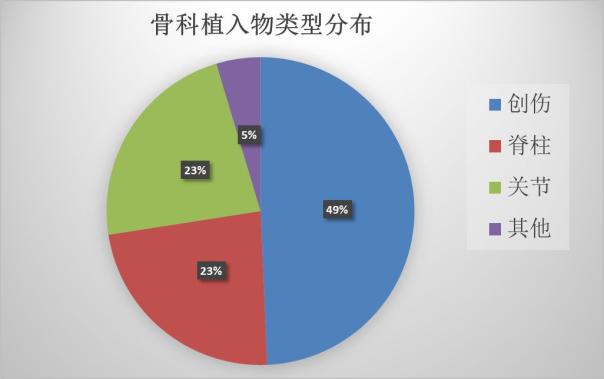
在植入性生物膜中,有三个国产生物心脏瓣膜获批,其中有两个是通过特别审批通道获批的创新医疗器械,分别是杭州启明医疗器械有限公司生产的创新产品“经皮介入人工心脏瓣膜系统”和苏州杰成医疗科技有限公司生产的创新产品“介入人工生物心脏瓣膜”。
在心血管介入器械中,2017年批准的药物洗脱支架均为进口,国内在研的可降解支架也尚无产品获批,国产器械中,只有2个药物涂层支架和2个主动脉支架获批,其中吉威医疗获批了2个雷帕霉素药物涂层支架系统,华脉泰科的腹主动脉覆膜支架系统被纳入创新医疗器械特别审批名单并成功获批。此外,垠艺生物的药物洗脱球囊因临床急需,且在我国尚无同品种产品获准注册,因此被纳入医疗器械优先审批名单并成功获批,从公示到最终获批,用时七个半月。
除垠艺生物的药物洗脱球囊之外,自2017年1月1日正式开始施行的医疗器械优先审批程序纳入的9个产品中,介入器械还有华脉泰科列入国家重点研发计划的胸主动脉覆膜支架系统。
2017年CFDA新公示了10批创新医疗器械特别审批的名单,纳入了64个创新医疗器械,其中,心血管介入器械就达到了18个。
2017纳入创新医疗器械特别审批的心血管产品
来源:火石创造